デジタル機器やIoTを治療に取り入れるデジタルセラピューティクス(デジタル治療、以下DTx)分野において、日本初のDTxが誕生する。バイオベンチャーの株式会社CureApp(キュア・アップ、東京都中央区)が開発し、薬事承認を申請していたニコチン依存症治療アプリとCOチェッカー(携帯型の呼気一酸化炭素濃度測定器)が、厚生労働省薬事・食品衛生審議会の医療機器・体外診断薬部会で了承を得た。事実上、国の承認を受けるめどが立ったことになり、晴れてDTxが日本でも医学的根拠に基づいて治療を行うデバイスと位置付けられた。今後、保険償還価格の決定を経て市場に出る。
CureAppは、2014年7月設立。佐竹晃太社長と、共同創業者である鈴木晋・取締役CDO(Chief Digital Officer)はともに医師。厚労省審議会での了承を受けて6月19日に行われた記者会見で、佐竹社長は「まったく新しい産業を創出していると自覚している」と発言に力を込めた。従来からの医薬品や医療機器を使用した、いわば伝統的な治療戦略に対し、同社のアプリは「新しい治療法だ」とも述べた。
「新しい治療法」の着目点は、患者の行動変容にある。例えば、禁煙治療においては、ニコチンへの身体的依存は禁煙補助薬で対処できるが、心理的依存への介入は限られた診療時間では限界があり、治療に「空白」が生じてしまう。この空白を埋めるのが、アプリの役割だ。
禁煙治療のほかにも、患者の生活習慣が影響することが多い慢性疾患治療に対して、同様のアプローチを取ることが可能になる。同社ではこのほか、高血圧や非アルコール性脂肪肝炎(NASH)の治療用アプリの開発を進めている。
■禁煙治療中、でもタバコを吸いたい… 「つらいですよね」
今回、厚労省審議会で了承されたニコチン依存症治療用アプリは、禁煙治療において医師の処方に基づいて使用することになる。
患者側は、「患者アプリ」を利用する際には医師から付与された処方コード入力する必要がある。アプリには日々の気分などを記録し、携帯型の「COチェッカー」と共に使用する。COチェッカーは患者アプリとBluetoothで接続されており、これを使って呼気中の一酸化炭素(CO)データの記録も行う。医師側のアプリでは、医師が診察時のデータや治療内容を記録する。患者側、医師側のそれぞれのデータ連携することで、アプリがリアルタイムで患者にアドバイスする。患者の状態が定期的に記録されるため、医師による診察もより効果的になることが期待される。
例えば、「タバコを吸いたい」と、患者が感じたとする。タバコに手を伸ばす代わりにスマホを手に取り、アプリに「タバコを吸いたくなった」と入力する。アプリは、「どうして吸いたくなったのですか」と質問し、患者の気持ちを引き出す。答えを入力すると、「つらいですよね」と共感してくれたり、「部屋の掃除をしましょう」など気を紛らわすアドバイスをしてくれたりする。いわば、認知行動療法(CBT)の手法で患者の禁煙治療をアシストするのだ。
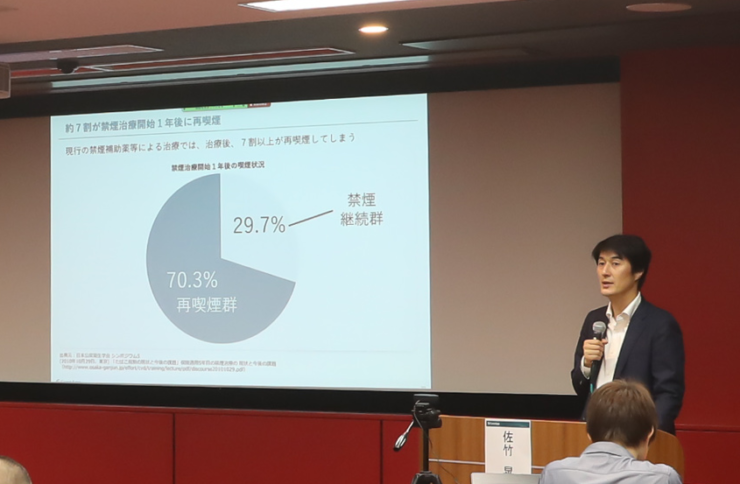
単純なアドバイスに見えるかもしれないが、タバコを吸いたい気持ちとの葛藤に堪えかねず挫折してしまうケースは、禁煙治療ではよくあることだ。同社が行った治験では、24週の治療期間が終了した時点での禁煙率は、アプリを併用した方が、通常の禁煙外来による治療よりも13.4%高く、統計学的な有意差を示した。また、禁煙補助薬の効果も5〜9%高まったとしている。
■米国からは10年遅れ、日本発のDTxに利点はあるか
本記事の〈前編〉でも述べたとおり、米国では初めてのDTxが米FDA(U.S. Food and Drug Administration アメリカ食品医薬局)の認可を受けたのは2010年だった。生活習慣病や薬物依存治療のほか、精神疾患の認知行動療法(CBT)などに使われるDTxが市場に出ている。
最近では、Akili Interactive(本社・米マサチューセッツ州)が開発した注意欠陥多動性障害(ADHD)治療のためのDTxがFDAの許可を受けた。ADHDをターゲットにしたDTxは米国でも初めてで、注目を集めた。Akili Interactiveも含め、米国ではDTxを担うのは、多くがスタートアップだ。Welldoc(本社・米メリーランド州)は同国で初めてFDAの許可を受けた企業で、成人の1型および2型糖尿病患者向けのDTxを開発したほか、社会問題となっている麻薬性鎮痛薬オピオイド中毒治療に取り組むPear Therapeutics(本社・米マサチューセッツ州)などがある。
ちなみに、海外で実用化されているDTxは、日本への展開にあたって日本の製薬大手と何らかの契約を結んでいるケースも多い。Akili Interactiveと塩野義製薬株式会社(本社・大阪市中央区)は、ADHDや自閉スペクトラム症(ASD)向けのDTxのライセンス契約を、Welldocとはアステラス製薬株式会社(本社・東京都中央区)が戦略的提携を、それぞれ締結している。
時間軸では日本は大幅に遅れているように感じられるが、不利な点ばかりではなさそうだ。米国でDTxの理解促進を図る非営利団体のDigital Therapeutics Alliance(DTA)のExecutive Directorであるメーガン・コーダー(Megan Coder)氏は、両国の健康保険制度の違いを指摘する。
米国には、健康保険給付を担う民間保険者が多数存在する。米国の制度下では、FDAの認可を受けても、民間保険者が健康保険で負担する価値があると認めなければ、保険適用の対象とならない。そのため、「それぞれの保険者にDTxの有用性を分かってもらう努力が欠かせない」(コーダー氏)といい、例えばメディケイド(アメリカ合衆国連邦政府による低所得者向けの医療保険制度)のようにDTxを保険適用の対象と認めていない民間保険者も存在する。
日本の場合は、アメリカとは保険制度が異なるため上記のようなケースが事業展開上の障壁となる可能性は低いと考えられる。この点については、CureAppの佐竹社長も同意見で、「ハードルを乗り越えた際の展開においては、地の利がある」と話している。
開発費用が数百〜数千億円とされる、従来の創薬の世界。これに対し、治療用アプリの開発はCureAppでは「数億〜数十億円」としており、期待される治療効果と合わせ、適正なリソースの使用につながるだろう。
■コロナ後の医療を占うDTx
コロナウイルスの流行を受けて、医療の分野でもさまざまな変化が求められている。このタイミングでの発表となったこともあり、CureAppの佐竹社長は、記者会見の場で「治療用アプリとオンライン診療が混同されることがある」と、両者の違いを強調した。オンライン診療は、診察を対面で行う代わりにテレビ電話などを使用してオンラインで医師が診察するのに対し、「アプリは診察以外の時間に介入するもの」だと説明した。
確かに、「オンライン」という共通点があるだけで、その目的は異なっている。が、直接の対面以外の選択肢が与えられているという設定は、これまでの医療にはなかったコンセプトだ。
米国でも、コロナウイルスの流行を受けてFDAが声明を発表し、認知行動療法に用いられるDTxなどについて、深刻な影響を引き起こさないと判断できる限りにおいて、所定の審査を経ずに市場に出て良いとする「驚くべき判断」(DTA・コーダー氏)のガイドラインを示した。
FDAの声明によると、対象となるのは認知行動療法やその他精神疾患治療を用途とするDTxだ。「ソーシャルディスタンシング中の精神疾患患者の精神状態の助けになるほか、医療従事者との接触を減らすと共に、公衆衛生の緊急事態に直面している医療機関への負担を減らすことにもなる」とその理由を説明している。
コロナウイルスの世界的な流行という、未曾有の自体を受けて医療現場も規制当局もこれまでとは異なる対応や判断が求められている。医療分野でのデジタルイノベーションはこの状況下で急遽、舞台の全面に押し出された感がある。
オンライン診断に関しても厚労省は今般、コロナウイルス対策として「時限的・特例的」に認める旨の事務連絡を行っているが、こうした事と併せて、DTxの普及を推進する観点からも今後の医療とデジタル・オンラインについてはどうあるべきか、各方面の動向を注意深く見守っていく必要があるだろう。